Theranostics in de strijd tegen kanker: twee voor de prijs van een - Karen Leys
De zoektocht naar een nieuw geneesmiddel begint meestal met 1.000.000 moleculen, maar levert slechts één enkel molecuul op dat de race naar de finish overleeft. Tijdens mijn thesis heb ik onderzoek gedaan naar één bepaald molecuul, in de hoop die ‘one in a million’ te vinden.
Het preliminaire onderzoek dat ik voor deze thesis heb uitgevoerd, toonde aan dat het DV1-K-(DV3)-peptide, een stuk van een bepaald eiwit bestaande uit D-aminozuren, een goede vector kan zijn voor bepaalde kankertypes (d.i. een molecuul dat ervoor zorgt dat het gebruikte geneesmiddel naar de juiste plaats in het lichaam gaat). Het gaat daarbij specifiek om kankertypes die de CXCR4-receptor, een soort van sensor, teveel hebben. Het doel is om het DV1-K-(DV3)-peptide op een theranostische wijze in te zetten; het is namelijk een peptide dat als vector zowel kan dienen bij diagnose als bij therapie. Het woord ‘theranostisch’ is dan ook een samenstelling van ‘diagnostisch’ en ‘therapeutisch’. Zo’n aanpak wordt meer en meer gebruikt in de strijd tegen kanker. Net daarom bleek het nuttig om te testen of het DV1-K-(DV3)-peptide een goede vector zou zijn bij deze dubbelzijdige benadering, namelijk bij beeldvorming en behandeling van kanker.
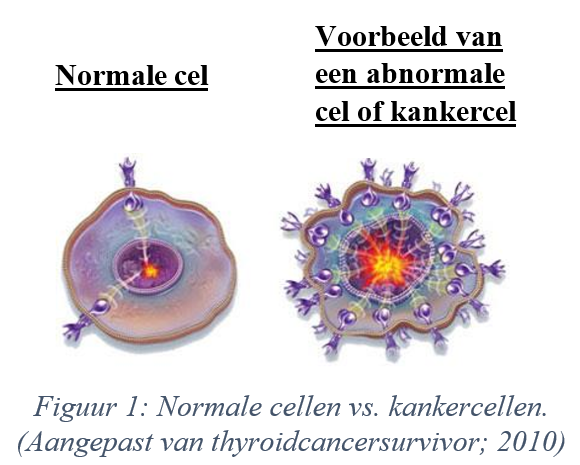
De figuur hierboven (thyroidcancersurvivor; 2010) toont het verschil tussen een normale cel (links) en een abnormale cel of kankercel (rechts). Normale cellen hebben maar enkele receptoren op de buitenrand, terwijl er bij afwijkende cellen teveel receptoren op de buitenrand staan. Dat zorgt ervoor dat stoffen die zich aan de receptoren van kankercellen binden, gebruikt kunnen worden om deze op te sporen en om ze vervolgens te bestrijden. Veel kankertypes hebben te veel CXCR4-receptoren, die bijgevolg een goed doelwit vormen bij het opsporen van tumoren.
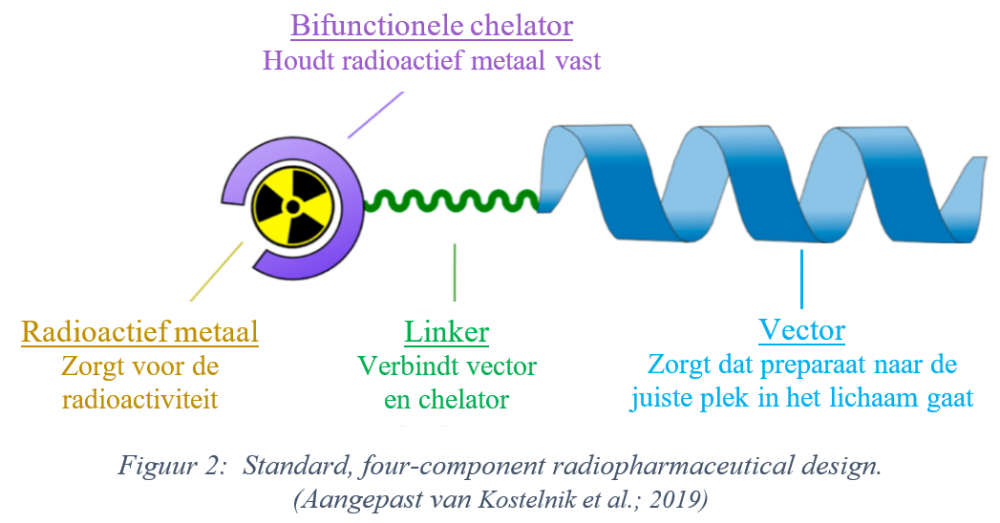
In het Radiopharmaceutical research lab van de K.U. Leuven werd het DV1-K-(DV3)-peptide gebruikt als vector in een radiofarmaceutisch preparaat of ‘tracer’. Die tracer (zie Figuur 2) bevat naast de vector ook een radioactief metaal, een bifunctionele chelator (wat het radioactief metaal vasthoudt) en een linker (een linkend element dat de vector en het geheel van chelator en metaal verbindt). Het gekozen radioactieve metaal bepaalt of het preparaat wordt gebruikt voor beeldvorming (o.a. PET-scans) of therapie; fluor-18 wordt bijvoorbeeld gebruikt bij beeldvorming, actinium-225 dan weer in een therapeutische context. Aangezien eenzelfde vectormolecuul (het DV1-K-(DV3)-peptide) voor zowel beeldvorming als therapie gebruikt kan worden, spreken we over een ‘theranostische’ aanpak.
Mijn werk begon bij het onderzoeken of de vector goed functioneert en enkel bindt waar nodig (op de CXCR4-receptoren). Daarvoor waren meerdere testen nodig met de DV1-K-(DV3)-tracer, die fluor-18 bevat. Fluor-18 werd gebruikt om via een PET-scan de weg te kunnen achterhalen die de radioactieve tracer aflegt in het lichaam, in eerste instantie in muizen en in een volgende fase in kankerpatiënten. Als onderzoeker hoopte ik dat de (gezonde) muizen de tracer relatief snel zouden uitplassen en daarnaast dat die tracer enkel naar de nieren en de blaas zou gaan, zonder zich verder te verspreiden naar andere organen. Bij een muis met een tumor zou de tracer idealiter vooral naar de tumor moeten gaan. Als de tracer in te hoge concentraties terug te vinden is in andere weefsels, dan is hij voor de beoogde organen niet meer bruikbaar, vanwege het gebrek aan contrast tussen normaal weefsel en tumoren.
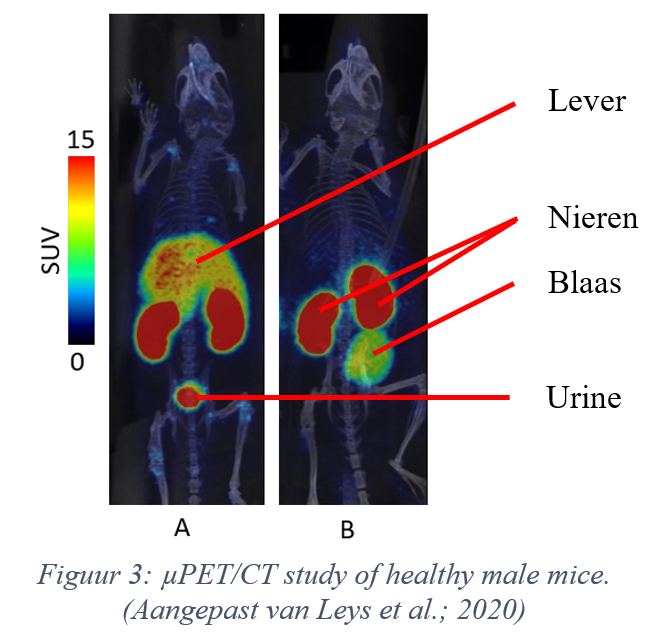
Bovenstaande figuur (Leys et al. 2020) laat zien waar in het lichaam van de onderzochte muizen de tracer zich bevindt, een uur na injectie. Muis A kreeg louter de tracer toegediend, terwijl muis B ook een stof geïnjecteerd kreeg die de CXCR4-receptor blokkeert. Het is gunstig als er aangetoond kan worden dat een tracer enkel en alleen bindt op de beoogde receptor, in dit geval de CXCR4-receptor, en voor deze bijgevolg specifiek is. Hoe specifieker de tracer, hoe beter. Vandaar dat ik, de onderzoeker achter deze thesis, de specifieke status van genoemde tracer bewees, door de binding ervan op de CXCR4-receptor te blokkeren en door vervolgens na te gaan of er nog steeds radioactiviteit aanwezig was in andere organen dan de nieren en de blaas, in dit onderzoek voornamelijk in de lever. Indien er in dit orgaan geen radioactiviteit meer te bespeuren valt, dan was de blokkering succesvol, kan de tracer niet binden en is die dus specifiek. Als er wel nog (in hoge mate) radioactiviteit te vinden is, dan is de tracer niet specifiek en bindt deze niet enkel op de beoogde receptor; de tracer is dan niet bruikbaar. Mijn studie heeft bevestigd dat de DV1-K-(DV3)-tracer specifiek is (zie Figuur 3). Bij muis A vertoont de lever een relatief hoge concentratie aan radioactiviteit; bij muis B (na blokkering) is dat niet meer het geval.
De PET-scan en andere proeven bevestigden dat het DV1-K-(DV3)-peptide als vector goede (farmacokinetische) eigenschappen vertoont (bij muizen). De tracer is namelijk specifiek en verlaat het lichaam op een snelle manier (via de urine). Bovendien is hij bij gezonde muizen enkel zichtbaar in de nieren, de blaas en slechts in mindere mate in de lever, waardoor het contrast in het merendeel van de organen vermoedelijk groot genoeg blijft om tumoren van normaal weefsel te kunnen onderscheiden.
De zoektocht naar een nieuw kankergeneesmiddel is nog lang niet afgerond, maar de besproken tracer lijkt, zij het dan voor de desbetreffende kankertypes, alvast veelbelovend en zou weleens dat ene geneesmiddel kunnen zijn dat de finishlijn haalt.
© Karen Leys
Literatuurlijst
Figuur gebaseerd op thyroidcancersurvivor. What is Cancer? [Internet]. 2010 [geciteerd 18 mei 2020]. Geraadpleegd via: https://thyroidcancersurvivor.wordpress.com/2010/10/13/what-is-cancer/
Figuur gebaseerd op Kostelnik TI, Orvig C. Radioactive Main Group and Rare Earth Metals for Imaging and Therapy. Chem Rev. 2019;119:902–56.
Figuur gebaseerd op Leys K, Bormans G, Cleeren F, Development and preclinical evaluation of new theranostic anti-CXCR4 radiopharmaceuticals. K.U. Leuven; 2020.









