Doelgerichte en plaatselijke afgifte van medicatie bij leverkanker: modelleren van het transport van medicatie doorheen de leverbloedvaten
Kanker is een ziekte waar we vroeg of laat allemaal, rechtstreeks of onrechtstreeks, mee geconfronteerd worden. Aangezien de ziekte zich manifesteert in veel verschillende hoedanigheden, is het – ondanks alle beschikbare wetenschappelijke informatie – nog steeds zeer moeilijk om te weten hoe ver we nu écht staan in het genezen van de ziekte. Wat we wel weten, is dat we steeds meer evolueren richting gepersonaliseerde behandelingen die uniek zijn voor iedere patiënt.
Dit onderzoek spitst zich toe op “op maat gemaakte” behandelingen voor hepatocellulair carcinoma (HCC). HCC is de meest voorkomende leverkanker en steekt steeds meer de kop op, o.a. wegens stijgend alcoholmisbruik. Wanneer het wegsnijden van de tumor(en) niet mogelijk is, is transarteriële radio- of chemo-embolisatie een mogelijke alternatieve behandeling. In dit onderzoek werd de nadruk gelegd op transarteriële chemo-embolisatie (TACE).
Wat is TACE?
Een gezonde lever wordt gevoed via 2 wegen: de poortader (75% van de totale bloedtoevoer) en de leverslagader (25%). Tumoren worden voornamelijk gevoed via de leverslagader. Bij TACE worden partikels – die de medicatie meevoeren – geïnjecteerd in deze leverslagader, die zich nog verder vertakt in kleinere slagaders. Hierbij is de bedoeling dat de partikels de voedende slagaders van de tumoren afsluiten. Wanneer er door deze slagaders geen bloed meer loopt, sterft het tumorweefsel af. Het verschil tussen TACE en standaard chemotherapie ligt in de gerichtheid van de afgifte van de medicatie. Bij standaard chemotherapie wordt in principe geen onderscheid gemaakt tussen ziek en gezond weefsel: de chemotherapeutica vallen alles aan dat ze op hun pad tegenkomen. Daarom valt deze behandeling veel patiënten ook heel zwaar. Bij TACE wordt ernaar gestreefd om de schadelijke effecten van de partikels enkel op het ziek weefsel te richten en het gezonde weefsel zoveel mogelijk te sparen. Dit verschil is schematisch weergegeven in Figuren 1a en 1b.
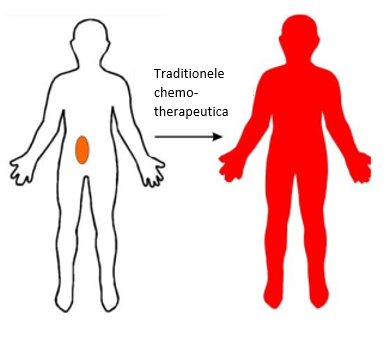
Figuur 1a: Standaard chemotherapeutica maken geen onderscheid tussen zieke en gezonde cellen. (Bron: [8])
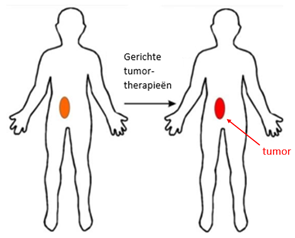
Figuur 1b: In TACE worden de schadelijke effecten van de partikels beperkt tot het tumorweefsel. (Bron: [8])
Van katheter naar kankercel
Bij TACE wordt een katheter in de bloedbaan gebracht via een prik in de liesslagader, waarna de katheter wordt opgeschoven tot in de leverslagader. Wanneer partikels via deze katheter geïnjecteerd worden, moeten ze zich een weg banen door een complex slagadernetwerk in de lever om zo dicht mogelijk bij het tumorweefsel terecht te komen. Met computermodellen kan de bloedstroming in de lever in kaart gebracht worden en kunnen de banen die deze partikels afleggen, berekend worden. Zo kan van elk geïnjecteerd partikel bepaald worden of ze uiteindelijk in gezond weefsel of ziek weefsel terecht komen. Aan de hand van computermodellen kan ook de optimale katheterlocatie bepaald worden zodanig dat er een maximum aantal partikels in ziek weefsel belandt. Het is dan de taak van de arts in kwestie om tijdens de TACE-procedure de katheter zo zorgvuldig mogelijk op deze optimale locatie te plaatsen. Ook andere variabelen, zoals het type medicatie, de snelheid van injectie en de hoek waaronder partikels geïnjecteerd worden, kunnen geoptimaliseerd worden met oog op de uiteindelijke bestemming van de partikels.
Doel van het onderzoek
In dit onderzoek werden partikelinjecties gesimuleerd in een patiënt-specifieke levergeometrie. De lever van deze patiënt was aangetast door cirrose, wat het transport van medicijnen door de bloedbaan aanzienlijk bemoeilijkte.
Het vernieuwende aan dit onderzoek was dat er hier voor een randvoorwaarde geopteerd werd die ons in staat stelde om de verschillende metabolische vereisten van gezond en ziek weefsel te kwantificeren. Onderzoek wijst namelijk uit dat tumorweefsel meer bloed vraagt dan gezond weefsel. Dit is belangrijk aangezien partikels gedragen worden door de bloedstroming. Om de impact van de verschillende metabolische vereisten te onderzoeken, werden verschillende scenario’s gemodelleerd waarin tumoren in de lever onderling verschilden in grootte en locatie.
Resultaten
In Figuur 2 is een schematische weergave van het slagadernetwerk van de lever gegeven. De leverzones waarin partikels na injectie kunnen belanden, zijn genummerd van 1 tot 21 (O1-O21) en hebben elk ook een unieke kleurcode.
In Figuur 3 is hetzelfde slagadernetwerk gevisualiseerd in een driedimensionale weergave.
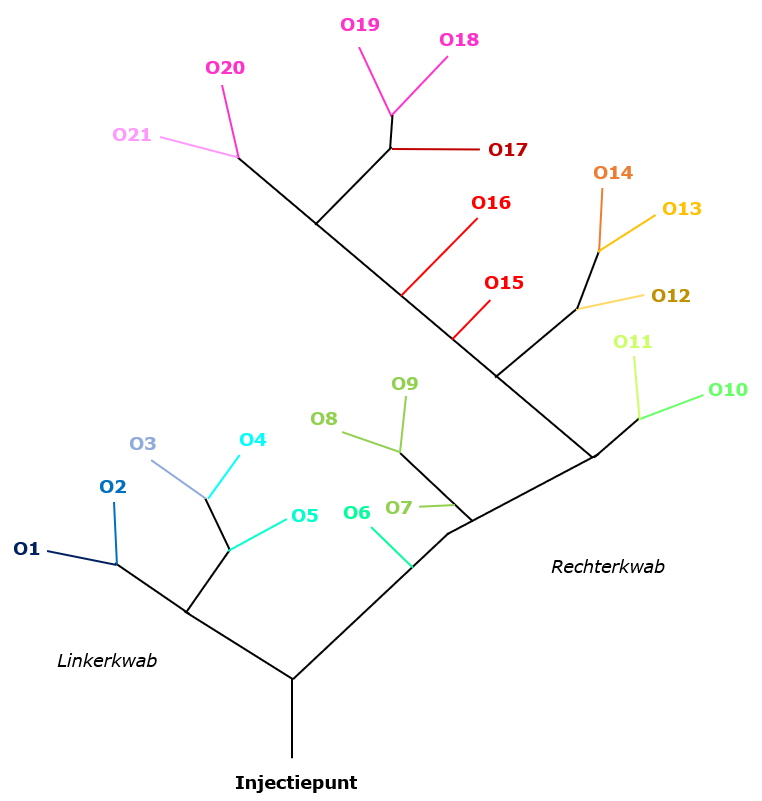
Figuur 2: Schematische weergave van het slagadernetwerk van de lever.
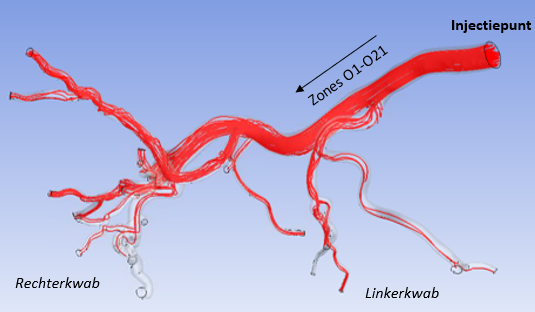
Figuur 3: 3D-weergave van het slagadernetwerk van de lever. De rode lijnen stellen partikelbanen voor.
In Figuren 4 tot 7 worden zogenaamde partikelverdelingskaarten weergegeven. Hierin zijn telkens doorsnedes van de leverslagader gevisualiseerd. Deze doorsnede is telkens genomen ter hoogte van het injectiepunt (zoals zichtbaar in Figuur 3). De kleuren in de partikelverdelingskaarten corresponderen met de kleurcodes voor de leverzones. Deze kaarten geven aan in welke van de 21 zones partikels belanden wanneer ze op dit specifieke punt van de doorsnede geïnjecteerd worden. Door de katheterlocatie te variëren tijdens de TACE-procedure, kunnen zo heel bewust bepaalde zones in de lever geviseerd worden.
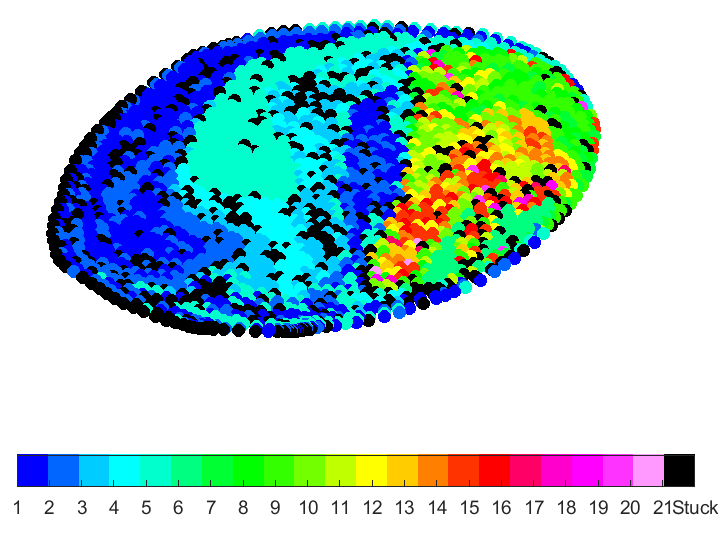
Figuur 4: Grote tumor in linkerkwab
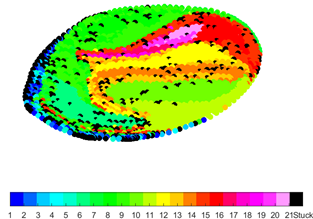
Figuur 5: Grote tumor in rechterkwab
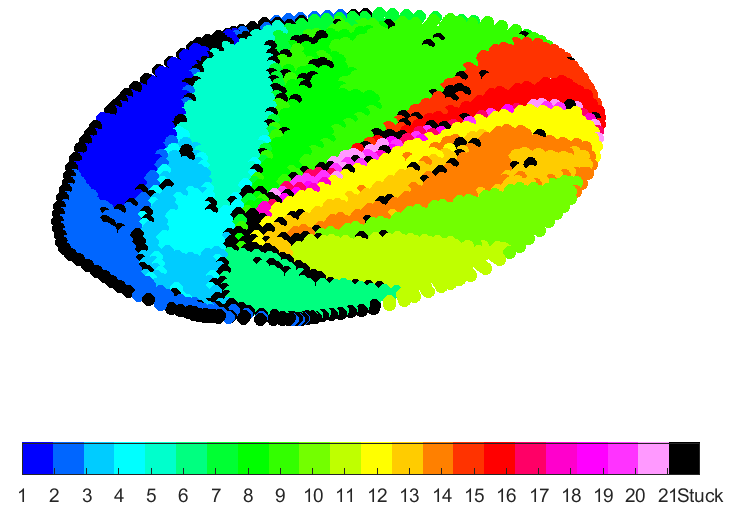
Figuur 6: Kleine tumor in linkerkwab
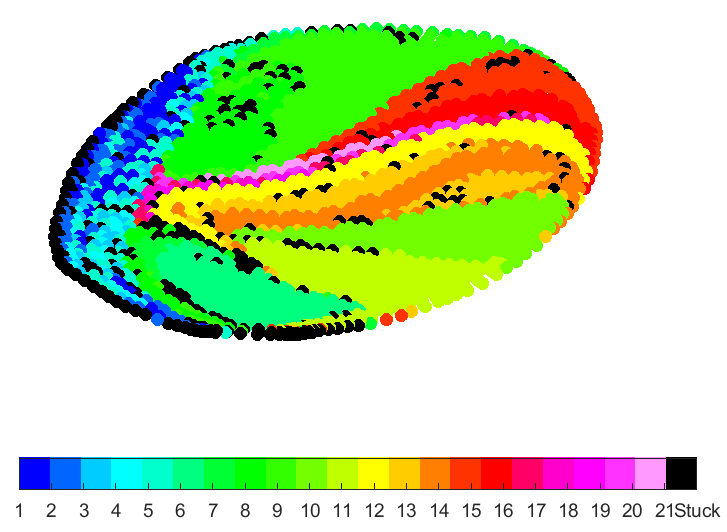
Figuur 7: Kleine tumor in rechterkwab
In Figuur 4 werd een grote tumor in de linkerkwab van de lever gemodelleerd. Een groot deel van de partikels belanden in vertakkingen 1 tot en met 5, die zich in de linkerkwab bevinden (donker- en lichtblauwe kleur). In Figuur 5 werd een grote tumor in de rechterkwab gemodelleerd. Het aantal partikels dat vloeit naar vertakkingen 1 tot en met 5 is hier zeer klein aangezien het merendeel van de partikels vloeit naar de rechterkwab. In Figuur 6 werd een kleine tumor in de linkerkwab gemodelleerd, in Figuur 7 een kleine tumor in de rechterkwab. Ook tussen deze twee figuren zijn de partikelverdelingskaarten significant verschillend.
Besluit en perspectieven
Dit onderzoek toont aan dat het belangrijk is om bij het berekenen van de partikelverdelingskaarten rekening te houden met de specifieke metabolische vereisten van de tumor, die samen met tumorlocatie en -grootte een belangrijke invloed uitoefenen op de partikelverdeling. Het modelleren van partikelinjecties kan bovendien een betekenisvolle rol spelen in het voorbereiden van op maakt gemaakte TACE-behandelingen. Met oog op toekomstige kankerbehandelingen kan het modelleren van het transport van medicijnen in de bloedbaan ons heel wat wijzer maken over het falen en slagen van vele therapieën.
Auteur: Tim Bomberna









