Hoe stamcellen ons helpen in de strijd tegen kanker
De voorbije jaren hebben wetenschappers een enorme vooruitgang geboekt in de strijd tegen kanker. Naast het gebruik van chemotherapie en radiotherapie (‘stralen’) kunnen ook onze eigen lichaamscellen aangewend worden om kankercellen te bestrijden. Zo spelen stamcellen een belangrijke rol in de behandeling van lymfeklierkanker. Hoe dat precies in elkaar zit, lees je in dit artikel.
Lymfeklierkanker
Het immuunsysteem zorgt voor de aanmaak van lymfocyten. Dat zijn cellen die ons helpen bij de afweer tegen vreemde indringers, bijvoorbeeld een virus. Sommige doen het rechtstreeks zelf (T-lymfocyten), andere maken antistoffen aan (B-lymfocyten). Deze cellen liggen verspreid over ons hele lichaam in het lymfeklierstelsel (oa in lymfeklieren en milt). Lymfeklierkanker ontstaat wanneer een van deze immuuncellen beslist autonoom te groeien. Een normale cel groeit volgens een bepaalde cyclus met ingebouwde controlepunten om de celgroei binnen de opgelegde grenzen te houden. Een tumorcel ontsnapt aan deze controlemechanismen en blijft ongeremd groeien. Vele cellen samen vormen een tumormassa. Op een gegeven moment is de tumormassa zo groot geworden dat we merken dat een persoon kanker heeft. We kunnen de vergrote lymfeklieren vol tumorcellen of een vergrote milt voelen of de zieke persoon vermagert omdat de tumorcellen al zijn energie opslorpen. Met deze klachten gaan zieke mensen naar de dokter. Deze stelt de diagnose door een stukje van zo’n lymfeklier weg te nemen (een lymfeklierbiopsie) en microscopisch te onderzoeken. De tumorcellen zien er onder de microscoop helemaal anders uit dan gewone cellen. De diagnose kanker wordt gesteld.
Autologe stamceltransplantatie
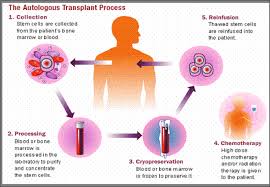
Stamcellen zijn cellen die kunnen uitgroeien tot eender welke cel in ons lichaam. Bij de geboorte beschikken we over heel wat stamcellen die delen en uitgroeien tot specifieke cellen met een bepaalde taak. Dergelijke cellen noemen we gedifferentieerde cellen. Er blijft echter ook een kleine voorraad stamcellen achter in een volwassen lichaam. Zo beschikken wij nu nog over cellen die eender welke cel in ons lichaam kunnen vervangen. Net zoals hart, long en nier getransplanteerd kunnen worden van een overleden donor naar een ontvanger, kunnen ook stamcellen getransplanteerd worden. Die stamcellen kunnen ofwel van de patiënt zelf afkomstig zijn (een autologe stamceltransplantatie) ofwel van een al dan niet verwante donor (een allogene stamceltransplantatie). De behandeling van kanker is erop gericht snel delende kankercellen uit te roeien. Dat doen we klassiek door het gebruik van chemotherapie of ioniserende stralen (radiotherapie). Helaas zijn er naast de tumorcellen ook heel wat gezonde cellen die door de chemotherapie en radiotherapie getroffen worden, zogenaamde ‘onschuldige slachtoffers’. Het gaat dan voornamelijk om cellen die snel delen, bijvoorbeeld de haarcellen (daarom verliezen sommige patiënten die chemotherapie krijgen hun haar) of de cellen in ons beenmerg. In ons beenmerg worden continu drie soorten cellen gemaakt: rode bloedcellen, witte bloedcellen en bloedplaatjes. De rode bloedcellen zorgen voor het transport van zuurstof doorheen het lichaam. De witte bloedcellen zorgen voor de afweer tegen infecties. De taak van bloedplaatjes is het vormen van klonters. Zo lopen we na een chemotherapiekuur een verhoogd risico op infecties, bloedingen en tekort aan zuurstofdragers. Wanneer we er echter in slagen om voor het toedienen van hoge dosissen chemotherapie stamcellen uit te zuiveren, hebben we minder schrik van het verlies van deze gezonde cellen. Dat is het principe van een autologe stamceltransplantatie (zie figuur 1). Daarbij krijgt de patiënt eerst een klassieke chemotherapiekuur. Voor het toedienen van hoge dosissen chemotherapie worden stamcellen door het geven van een groeifactor losgeweekt uit het beenmerg en gemobiliseerd in de bloedbaan. Via een bloedafname worden de stamcellen uit het lichaam gehaald en op zeer koude temperatuur bewaard. Vervolgens krijgt de patiënt hoge dosissen chemotherapie. We hopen dat de chemotherapie de tumorcellen overwint, helaas zullen onze gezonde snel delende cellen hierdoor ook in mankracht verliezen. Op een gegeven moment heeft de patiënt nog een bedreigend laag aantal rode bloedcellen, witte bloedcellen en bloedplaatjes over. Dan worden de stamcellen ontdooid en teruggegeven aan de patiënt. Deze stamcellen groeien dan weer uit tot rode bloedcellen, witte bloedcellen en bloedplaatjes en zorgen ervoor dat de patiënt minder risico heeft te overlijden ten gevolge van een levensgevaarlijke infectie of bloeding. Helaas is deze procedure niet zonder risico’s. Ondanks de enorme vooruitgang in dit soort behandeling de voorbije jaren overleeft ongeveer 3% een autologe stamceltransplantatie niet.
Resultaten bij patiënten met mantelcellymfoom
In mijn onderzoek ben ik gaan kijken naar de resultaten van autologe stamceltransplantatie bij patiënten met een mantelcellymfoom. Dat is een agressieve vorm van lymfeklierkanker waarbij B-lymfocyten ongeremd beginnen groeien. De 58 onderzochte patiënten kregen meteen na diagnose chemotherapie gevolgd door een autologe stamceltransplantatie. Uit de resultaten blijkt dat patiënten in complete remissie voor de transplantatie (alle tumorcellen uitgeroeid na de chemotherapie) minder snel hervielen dan patiënten in partiële remissie voor de transplantatie (nog een beperkt aantal tumorcellen aanwezig na de chemotherapie). Daarnaast heb ik vastgesteld dat de MIPI score (Mantle Cell Lymphoma International Prognostic Index) als scoresysteem in staat is de patiënten in te delen in verschillende prognostische categorieën met een verschillende totale overleving. Gezien 3% overlijdt ten gevolge van de stamceltransplantatie blijft de uitdaging voor de toekomst goed te selecteren welke patiënten voor een autologe stamceltransplantatie in aanmerking komen. Dat kan aan de hand van prognostische factoren, bijvoorbeeld de MIPI score en de hoeveelheid achtergebleven tumorcellen na de klassieke chemotherapie. Het is immers belangrijk om de tumor tot op de laatste cel uit te roeien voor de transplantatie. De ontwikkeling van nieuwe chemotherapeutische agentia speelt daarbij een belangrijke rol. Voorbeelden daarvan zijn antistoffen gericht tegen tumorspecifieke eiwitten. Mantelcellymfoomcellen exprimeren het eiwit CD20 op hun oppervlak met als gevolg dat deze tumorcellen aangevallen worden door de antistof “rituximab” specifiek gericht tegen CD20. Gezonde cellen die geen CD20 op hun oppervlak exprimeren, worden zo niet getroffen.
Besluit
Ondanks enorme vooruitgang is de strijd tegen kanker helaas nog niet gestreden. Bij het mantelcellymfoom steekt de kanker vroeg of laat weer de kop op. We zijn nog niet in staat een patiënt met een mantelcellymfoom definitief te genezen. Onderzoek blijft nodig om behandelingen te ontwikkelen die de tumor overwinnen, vooraleer de tumor ons overwint.









